泊沙康唑是新型廣譜三唑類抗真菌藥物����,具有與其他唑類衍生物相同的抗真菌作用機(jī)制。常用于預(yù)防侵襲性曲霉菌和念珠菌感染��。第一個上市的泊沙康唑劑型為泊沙康唑口服混懸液����,由于口服混懸液的吸收受到食物和胃腸道條件(如pH及促胃動力藥物)的影響,導(dǎo)致口服混懸液血藥濃度達(dá)標(biāo)率很低���。因此����,泊沙康唑的改進(jìn)劑型——泊沙康唑注射液及泊沙康唑腸溶片隨后獲批上市����,兩種新劑型提供了更高、更穩(wěn)定的的藥物暴露��,從而提供了更優(yōu)的預(yù)防及治療療效。
愛宣奧?(泊沙康唑注射液)是由江蘇奧賽康藥業(yè)有限公司獨家推出的首個國產(chǎn)泊沙康唑注射液����。在國內(nèi)首家開展多項臨床研究,主要有健康人群中單次給藥藥代動力學(xué)及安全性研究���、泊沙康唑注射液在健康人群中隨機(jī)���、開放、兩周期�����、兩序列���、兩交叉藥代動力學(xué)對比研究以及泊沙康唑注射液在高危人群中的藥代動力學(xué)和安全性研究�����,獲得了該藥物在中國人群的藥代動力學(xué)及藥效學(xué)數(shù)據(jù)�����,且與原研產(chǎn)品進(jìn)行了完整的生物等效性研究�,從而通過了質(zhì)量與療效一致性評價�����。近期《泊沙康唑注射液在侵襲性真菌病高?����;颊咧械乃幋鷦恿W(xué)和安全性評價》的研究結(jié)果在中國臨床藥理學(xué)雜志(Chin J Pharmacol)發(fā)表��。

研究背景
血液病患者侵襲性真菌?�。↖FD)的總體發(fā)病率呈現(xiàn)上升趨勢��,伴隨著較高的病死率�����;
泊沙康唑被認(rèn)為是血液病患者IFD預(yù)防的最佳藥物�����,但是泊沙康唑口服混懸液的生物利用度較低���,預(yù)防效果仍無法滿足臨床需求����;
國產(chǎn)泊沙康唑注射液無需經(jīng)過口服吸收,生物利用度更高�,但其在高危人群中的藥代動力學(xué)和安全性還沒有完全明確。
研究設(shè)計
A組受試者第1~10天給予泊沙康唑注射液�,每次 300mg(第1天,bid���;第2天����,qd)�;第11~28天能耐受口服的受試者轉(zhuǎn)為泊沙康唑口服混懸液給藥,每次200mg���,tid�。
B組第1~5天給予泊沙康唑注射液����,每次300mg(第1天,bid����;第2~5天���,qd);第6~28天��,能耐受口服的受試者轉(zhuǎn)為泊沙康唑口服混懸液�����,每次200mg����,tid�����。
A組受試者采樣時間為在第 1���,3�,6���,8���,10��,15���,22和28天給藥前30min內(nèi)采集血樣;第1天和第10天在給藥前30min內(nèi)����、給藥開始后1,1.5���,1.75����,4���,8和12h(第1天在第2次給藥前30min內(nèi)采集12h的樣本)和24h(次日給藥前30min內(nèi))采集血樣��。
B組受試者采樣時間為在第1�����,3�,6,10�,15,22和28天給藥前30min內(nèi)以及第1天和第3天在給藥開始后1.5和4h采集血液��。
研究結(jié)果
1�、PK結(jié)果
A組第1天和第10天給藥后血漿中泊沙康唑濃度的平均藥時曲線,見下圖1所示���。本研究 A組靜脈連續(xù)給藥泊沙康唑注射液第10天的AUC0-12h是第1天的3倍��。第1天和第10天的Tmax中位數(shù)分別為1.50和1.48h ,均在滴注結(jié)束時達(dá)到最大濃度。
本試驗靜脈給藥后PK參數(shù)與原研P05520試驗密集組的第10/14天的PK結(jié)果參數(shù)比較��,本試驗靜脈給藥后第10天的Tmax與原研結(jié)果接近��,而Cmax�、Cmin、Cavg�����、AUC0-24h均高于原研結(jié)果�。
本研究A組第2,5���,7�����,9和10天的Cmin值分別為1233.10±300.56���,1584.01±726.89�����,1790.03±817.13�,1973.29±946.96和1744.95±871.55ng·mL-1���,差異無統(tǒng)計學(xué)意義(P>0.05)�����,提示靜脈給藥后第3天已達(dá)穩(wěn)態(tài)血藥濃度���。
本試究A組和B組58例受試者的第3天Cmin值在500ng·mL-1~2500 ng·mL-1之間的有57例。A組和B組轉(zhuǎn)為口服混懸液后的Cmin值顯著降低�,同時口服混懸液的Cmin值變異(CV:25.21%~87.42%)比靜脈注射液(CV:30.60%~49.95%)的更大,轉(zhuǎn)化為口服混懸液后Cmin<500ng·mL-1的受試者比例增加�,與原研結(jié)果基本相當(dāng)����。
本試驗采用非線性混合效應(yīng)模型(NONMEM)建立泊沙康唑注射液在中國侵襲性真菌感染高危受試者中的PopPK模型�����,評估泊沙康唑注射液給藥后的PK特征和影響因素�。PopPK模型仿真(n=1000),穩(wěn)態(tài) Cmin介于500ng·mL-1至2500 ng·mL-1間的百分比(87.8%%)與原研注射液(86.5%)結(jié)果接近�。
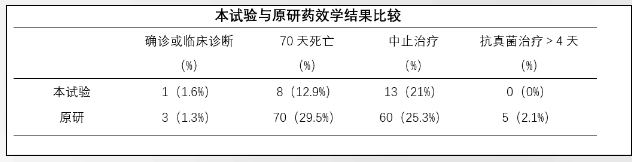
2、藥效學(xué)結(jié)果
本試驗與原研結(jié)果對比見表���。
3��、安全性結(jié)果
試驗期間,共有61例受試者出現(xiàn)不良事件�����,共發(fā)生725例次�, 725例次不良事件中有190例次與藥物有關(guān)。從藥物不良反應(yīng)的整體發(fā)生來看���,本試驗的藥物不良反應(yīng)發(fā)生類型少于原研主要報道��,但個例類型藥物不良反應(yīng)發(fā)生率與原研相當(dāng)���。
4�、總結(jié)
愛宣奧?注射液第1天和第10天的Tmax中位數(shù)分別為1.50和1.48h ,均在滴注結(jié)束時達(dá)到最大濃度
愛宣奧?注射液靜脈給藥后第3天已達(dá)穩(wěn)態(tài)血藥濃度
愛宣奧?注射液穩(wěn)態(tài)Cmin在500到2500ngmL-1之間的幾率與原研注射液的結(jié)果接近
愛宣奧?注射液不良反應(yīng)發(fā)生類型少于原研主要報道����,個例類型藥物不良反應(yīng)發(fā)生率與原研相當(dāng)